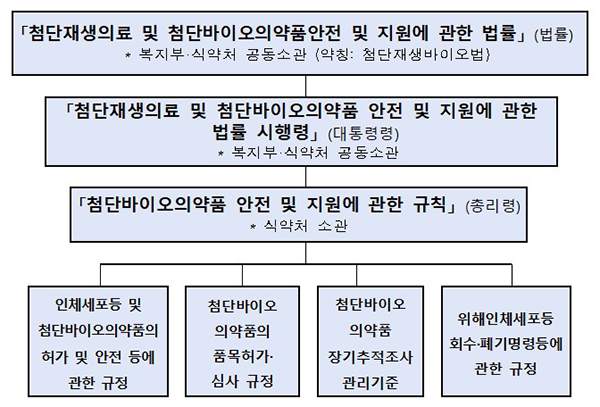
식품의약품안전처가 바이오의약품의 품질과 안전에 대한 관리를 강화하고, 신속한 제품화를 지원하기 위해 첨단재생바이오법 하위법령을 제정해 본격적으로 시행한다고 7일 밝혔다.
식약처는 법률에서 위임한 세부사항을 담은 시행령·시행규칙·행정규칙의 제정을 완료하고 관련 예산을 확보해 시행에 차질이 없도록 할 계획이다.

◆ 바이오의약품 품질·안전 관리 강화
이번에 제정된 규칙에서는 바이오의약품 품질과 안전관리 강화를 위해 첨단바이오의약품의 원료로 사용하는 인체세포 등을 전문적으로 취급하는 업종을 신설하고, 인체세포 등의 품질 및 안전성 확보를 위한 기준을 마련했다.
세포처리 시설과 인체세포 등 관리업을 하기 위해서는 법에서 정한 시설·인력·장비 등을 갖춰 허가를 신청해야 하고, 서류검토와 실태조사를 통해 적합한 경우 승인받게 된다.
아울러 인체세포 등 관리업자는 정기적으로 시설을 점검하고 품질검사를 실시해야 하며 위해인체세포 등을 발견한 경우 식약처에 즉시 보고 해야 한다.
또한 첨단바이오의약품 사용 후 중대한 이상 사례가 발생한 경우 철저히 조사하고 사용 중단 등 신속한 조치가 이뤄진다.
장기 추적조사 대상으로 지정된 첨단바이오의약품은 업체가 제품을 판매하기 전까지 장기 추적조사 계획을 식약처에 제출하고, 이를 투여하는 의사는 환자의 동의를 받아 첨단바이오의약품 규제과학센터에 환자의 인적사항을 등록하며 업체는 장기 추적조사의 진행상황을 식약처에 보고해야 한다.
만약 중대한 이상 사례가 발생한 경우 업체는 15일 이내 식약처에 조사계획을 보고하고 6개월 이내 발생 원인과 약물과의 인과관계 및 대처방안을 마련해야 한다.
식약처는 현재 시판 중인 세포치료제의 안전성과 품질기준에 대해 다시 한번 검증해 품목을 허가하겠다고 밝혔다.
특히 법 시행 이후 1년 이내에 기존 제품을 다시 허가받도록 법에서 정함에 따라 식약처는 품목 허가 당시 제출했던 자료를 평가하고, 위해성 관리계획 등을 제출받아 검토한다.
◆ 바이오의약품 제품화 지원
식약처는 신속한 개발이 필요한 첨단바이오의약품을 신속처리대상으로 지정해 개발 초기부터 맞춤형 심사·우선심사를 통해 제품화를 지원할 계획이다.
여기에서 신속처리대상은 대체 치료제가 없는 중대한 질환, 희귀질환 관리법에 따른 희귀질환, 대유행 감염병의 예방·치료를 목적으로 하는 첨단바이오의약품을 포함한다.
이에 지정된 의약품이 초기 임상시험 결과나 임상시험 과정에서 안전성·유효성이 확보됨을 확인할 수 있는 자료를 제시하는 경우 추후 임상시험자료를 제출하는 것을 조건으로 허가하게 된다.
아울러 최첨단 바이오기술을 활용한 제품이 첨단바이오의약품에 해당하는지 여부를 확인해줌으로써 개발자의 연구개발 가능성을 높일 수 있도록 품목분류제도를 운영한다.
이를 위해 바이오의약품에 대한 종합적인 정보와 기술을 지원하는 기관으로 한국의약품안전관리원을 지정하고, 백신개발을 지원하기 위해 백신안전기술지원센터의 설립을 추진한다.
또한 한국의약품안전관리원을 첨단바이오의약품 규제과학센터로 지정해 첨단바이오의약품 관련제도의 조사 연구와 제조 및 품질관리에 필요한 전문인력을 양성할 계획이다.
식약처는 첨단바이오의약품의 규제 선진화와 안전관리를 위한 규제과학센터 운영 예산으로 2021년도 예산 38억 원을 정부예산으로 편성했다.
한편 백신안전기술지원센터는 국내 필수 백신의 제품화 지원을 위해 백신 개발을 위한 컨설팅을 비롯해 임상시험, 품질검사 및 전문 인력 양성을 추진하고자 2021년 58억 원을 편성했다.
이의경 식약처장은 “안전과 품질이 확보된 바이오의약품의 제품화 지원을 위해 맞춤형 허가정책을 운영해 나가겠다”며 “첨단재생바이오법의 시행으로 첨단바이오 의약품의 품질 및 안전 관리를 강화해 제품 경쟁력을 높이는 한편 희귀·난치 질환자에게 새로운 치료기회를 제공하게 될 것”이라고 말했다.
문의 : 식품의약품안전처 바이오생약국 바이오의약품정책과(043-719-3651), 바이오의약품품질관리과(043-719-3652)
- 공공누리 출처표시의 조건에 따라 자유이용이 가능합니다. (텍스트)
- 단, 사진, 이미지, 일러스트, 동영상 등의 일부 자료는 문화체육관광부가 저작권 전부를 보유하고 있지 아니하므로, 반드시 해당 저작권자의 허락을 받으셔야 합니다.
문의처 : 문화체육관광부 정책포털과
| 뉴스 |
|
|---|---|
| 멀티미디어 |
|
| 브리핑룸 |
|
| 정책자료 |
|
| 정부기관 SNS |
|
※ 브리핑룸 보도자료는 각 부·처·기관으로부터 연계로 자동유입되는 자료로 보도자료에 포함된 연락처로 문의
※ 전문자료와 전자책의 이용은 각 자료를 발간한 해당 부처로 문의
- 제37조(출처의 명시)
- ① 이 관에 따라 저작물을 이용하는 자는 그 출처를 명시하여야 한다. 다만, 제26조, 제29조부터 제32조까지,
제34조 및 제35조의2의 경우에는 그러하지 아니하다. <개정 2011. 12. 2.> - ② 출처의 명시는 저작물의 이용 상황에 따라 합리적이라고 인정되는 방법으로 하여야 하며, 저작자의 실명
또는 이명이 표시된 저작물인 경우에는 그 실명 또는 이명을 명시하여야 한다.
- 제138조(벌칙)
- 다음 각 호의 어느 하나에 해당하는 자는 500만원 이하의 벌금에 처한다. <개정 2011. 12. 2.>
- 1. 제35조제4항을 위반한 자
- 2. 제37조(제87조 및 제94조에 따라 준용되는 경우를 포함한다)를 위반하여 출처를 명시하지 아니한 자
- 3. 제58조제3항(제63조의2, 제88조 및 제96조에 따라 준용되는 경우를 포함한다)을 위반하여 저작재산권자의 표지를 하지 아니한 자
- 4. 제58조의2제2항(제63조의2, 제88조 및 제96조에 따라 준용되는 경우를 포함한다)을 위반하여 저작자에게 알리지 아니한 자
- 5. 제105조제1항에 따른 신고를 하지 아니하고 저작권대리중개업을 하거나, 제109조제2항에 따른 영업의 폐쇄명령을 받고 계속 그 영업을 한 자 [제목개정 2011. 12. 2.]
이전다음기사
다음기사인플루엔자 4가 백신 무료접종 시작…대상 늘려 1900만명 지원정책브리핑 게시물 운영원칙에 따라 다음과 같은 게시물은 삭제 또는 계정이 차단 될 수 있습니다.
- 1. 타인의 메일주소, 전화번호, 주민등록번호 등의 개인정보 또는 해당 정보를 게재하는 경우
- 2. 확인되지 않은 내용으로 타인의 명예를 훼손시키는 경우
- 3. 공공질서 및 미풍양속에 위반되는 내용을 유포하거나 링크시키는 경우
- 4. 욕설 및 비속어의 사용 및 특정 인종, 성별, 지역 또는 특정한 정치적 견해를 비하하는 용어를 게시하는 경우
- 5. 불법복제, 바이러스, 해킹 등을 조장하는 내용인 경우
- 6. 영리를 목적으로 하는 광고 또는 특정 개인(단체)의 홍보성 글인 경우
- 7. 타인의 저작물(기사, 사진 등 링크)을 무단으로 게시하여 저작권 침해에 해당하는 글
- 8. 범죄와 관련있거나 범죄를 유도하는 행위 및 관련 내용을 게시한 경우
- 9. 공인이나 특정이슈와 관련된 당사자 및 당사자의 주변인, 지인 등을 가장 또는 사칭하여 글을 게시하는 경우
- 10. 해당 기사나 게시글의 내용과 관련없는 특정 의견, 주장, 정보 등을 게시하는 경우
- 11. 동일한 제목, 내용의 글 또는 일부분만 변경해서 글을 반복 게재하는 경우
- 12. 기타 관계법령에 위배된다고 판단되는 경우
- 13. 수사기관 등의 공식적인 요청이 있는 경우
 이 누리집은 대한민국 공식 전자정부 누리집입니다.
이 누리집은 대한민국 공식 전자정부 누리집입니다.





















